Ионообменная хроматография
В ионообменной хроматографии разделение компонентов смеси достигается за счет обратимого взаимодействия ионизирующихся веществ с ионными группами сорбента. Сохранение электронейтральности сорбента обеспечивается наличием способных к ионному обмену противоионов, расположенных в непосредственной близости к поверхности. Ион введенного образца, взаимодействуя с фиксированным зарядом сорбента, обменивается с противоионом. вещества, имеющие разное сродство к фиксированным зарядам, разделяются на анионитах или на катеонитах. Аниониты имеют на поверхности положительно заряженные группы и сорбируют из подвижной фазы анионы. Катиониты соответственно содержат группы с отрицательным зарядом, взаимодействующие с катионами. Амфотерные (биполярные) иониты содержат в своей матрице и катионные и анионные обмениваемые группы. Эти иониты способны образовывать внутренние соли, которые диссоциируют в контакте с электролитами и связывают оба их компонента. Амфотерные иониты легко регенерируются водой.
В качестве ПФ в ионообменной хроматографии используют ионные растворы (водные растворы солей, кислот и оснований), т.е. системы растворителей, имеющих высокое значение диэлектрической проницаемости и способность ионизировать соединения. Обычно работают с буферными растворами, поддерживающими определенные значения рН.
При хроматографическом разделении ионы анализируемого вещества конкурируют с ионами, содержащимися в элюенте, стремясь вступать во взаимодействие с противоположно заряженными группами сорбента. Отсюда следует, что ионообменную хроматографию можно применять для разделения любых соединений, которые могут быть каким-либо образом ионизированы.
Ионообменная хроматография целесообразна при разделении высокополярных веществ, которые без перевода в производные не могут быть проанализированы методом ГЖХ. К таким соединениям относятся аминокислоты, пептиды, гетероциклические основания, углеводы.
Механизм анионного обмена можно представить в виде уравнения:
X - + R+Y - ↔ Y - + R+X -
Аналогично уравнение для катионного обмена:
Х+ + R -Y+ ↔ Y+ + R -X+
В первом случае ион образца X - конкурирует с ионом подвижной фазы Y - за ионные центры R+ ионообменника, а во втором в конкуренцию с ионами подвижной фазы Y+ за ионные центры R - вступают катионы образца Х+.
Естественно, что ионы анализируемой пробы, слабо взаимодействующие с ионообменником, при этой конкуренции будут слабо удерживаться в колонке и первыми вымываться из нее и, наоборот, наиболее сильно удерживаемые ионы будут элюированы из колонки последними. Кроме ионных-ионных взаимодействий на поверхности сорбента возникают вторичные взаимодействия неионной природы за счет адсорбции или водородных связей сорбата с неионной частью матрицы или за счет ограниченной растворимости образца в подвижной фазе. Трудно добиться условий, при которых удерживание осуществляется только по ионообменному механизму. Поэтому при прогнозировании удерживания необходимо исходить не только из теоретических закономерностей ионообменной хроматографии, но и из эмпирических наблюдений. Разделение конкретных веществ зависит в первую очередь от выбора наиболее подходящего сорбента и подвижной фазы. В качестве неподвижных фаз в ионообменной хроматографии применяют ионообменные смолы и силикагели с привитыми ионогенными группами.
Применяемые в ВЭЖХ ионообменные смолы представляют собой в основном сополимеры стирола и дивинилбензола. Относительное содержание дивинилбензола, определяющее степень сшивки скелета ионита выражают в массовых процентах дивинилбензола в мономерной смеси. Обычно добавляют 8-12% последнего. Чем больше содержание дивинилбензола, тем больше жесткость и прочность полимера, выше емкость и, как правило, селективность и тем меньше набухаемость.
Хроматографические материалы, содержащие сульфатные или триалкиламмонийные группы, являются сильными катионнообменниками и сильными анионообменниками и называются соответственно SCX и SAX. Слабые катионообменники и анионообменники получают на основе ионов карбоксилата -СОО - или аммония -NH3+ соответственно. Существуют также жидкие органические ионообменники - несмешивающиеся с водой жидкости, физически нанесенные на пористые или поверхностно-пористые материалы. Жидкие анионообменники - высокомолекулярные амины или их соли, а катионообменники - эфиры фосфорной или фосфиновых кислот.
Для улучшения условий разделения в ионообменной хроматографии иногда получают лигандные комплексы ионов, изменяя при этом их полярность
Fe3+ + 4Сl - ↔ FeCl4-
и делят на анионообменном носителе анионы тетрахлоржелеза. Так как селективность смолы зависит от характера противоиона, часто необходимо изменить форму смолы. Противоионы связаны кулоновскими силами взаимного притяжения с ионообменными группами и экранируют их заряд. Это притяжение зависит от физической природы противоиона, размеров, формы, плотности электронных оболочек. Одни противоионы при равенстве концентраций могут замещать в ионообменнике другие. Ниже приведены ряды противоионов в порядке убывающей активности и уменьшения сродства к ионообменной смоле.
HSO4- > ClO3- > NO3- > Br - > CN - > НСО3- > СН3СОО - > OH - > F -
Ва2+ > Pb2+ > Са2+> Ni2+ > Cd2+ > Со2+ > Zn2+ > Mg2+ > Ag+ > Cs+ > Rb+ > K+ > NH42+ > Na+ > H+ > Li+
M4+ > M3+ > M2+ > M1+
Наиболее быстрый метод превращения анионита в форму, которая в ряду селективности стоит выше исходной, состоит в промывании ее четырехкратным объемом 1 М раствора соответствующей соли. Если для работы необходима форма слабее исходной, то ее сначала переводят в гидроксильную форму, промывая 20-кратным количествам 1 М раствора NaOH, а затем уже превращают в нужную форму. Катеониты переводят в требуемую форму промыванием 1 М раствором нитрата соответствующего металла.
При изменении ионной формы смолы или в присутствии органических растворителей, таких, как ацетонитрил, ТГФ, может изменяться и объем смолы. Если смола уменьшается в объеме, упаковка в колонке оседает и образуется мертвый объем наверху колонки. Это оседание сопровождается потерей эффективности. Если смола набухает и упаковка в колонке увеличивается, то возрастает сопротивление в колонке, что значительно уменьшает скорость потока и может даже привести к разрушению сорбента. Невысокая стабильность ионогенных материалов является одним из недостатков ионообменной хроматографии, причем анионообменники менее стабильны, чем катионообменники. Для увеличения срока службы колонок используют предколонки, а также регенерацию колонок сильным растворителем. Катиониты, например, регенерируют, обрабатывая 1 М азотной кислотой и продолжительно промывая той подвижной фазой, которая будет использована.
Ионообменники характеризуются степенью набухания и емкостью. Степенью набухания называют объем упакованного в колонну обменника (в мл), приходящийся на 1 г его в сухом виде, и имеет размерность мл/г. Максимальное количество ионов, которое может связать ионообменник, определяет его обменная емкость, которая совпадает с концентрацией ионогенных групп. Ёмкость выражается числам ммоль эквивалентов обмениваемого иона на 1 г сухого обменника (ммоль экв/г) или на 1 мл упакованного в колонну набухшего ионообменника (ммоль экв/мл) при значениях рН, соответствующих его полной ионизации. Для высокомолекулярных ионов или амфолитов, например белков, вводят понятие "эффективная" обменная емкость, которая зависит от размера молекулы амфолита, расстояния между ионогенными группами и степени доступности всего объема пористой матрицы обменника для этих молекул. Понятия емкости и эффективной емкости могут не совпадать. Иногда приходится снижать полезную емкость сорбента за счет изменения рН, увеличивая при этом его эффективную емкость. Катионообменные смолы имеют емкость около 4,4 ммоль экв/г, а анионообменные - 3,5-4 ммоль экв/г для гелеобразной структуры и 2,5 ммоль экв/г для пористой. Обменная емкость изменяется при изменении рН. При низких рН происходит нейтрализация катионита при добавлении протона:
R - + Н+ ↔ R -H+,
а при высоких рН подобным образом при действии щелочи нейтрализуются аниониты:
R+ + OН - ↔ R+OH -.
Ионообменная емкость сильных катионитов примерно постоянна в диапазоне рН=2-11, но падает до нуля при низких рН, поэтому они не могут быть использованы при рН<1. Сильные аниониты должны применяться при рН<11, слабые катиониты при рН>6, а слабые аниониты при рН<8. Сильные ионообменники могут быть использованы в более широком диапазоне рН, чем слабые. Этим объясняется широкое применение сильных ионитов, на которых может быть разделено большее количество веществ разных классов одновременно, особенно если применяют градиентное изменение рН. Прочно удерживаемые вещества, нестойкие при крайних значениях рН, целесообразно разделять на слабых ионитах. В отличие от сильных ионитов полностью ионизированых при рН=2-11, слабые иониты полностью ионизированы в ограниченной области рН, и их ионизацией можно управлять, варьируя рН элюента в пределах диапазона рабочих значений рН.
Подвижная фаза в ионообменной хроматографии должна обеспечивать растворимость различных солей и иметь свойства буферного раствора, необходимые для ионного обмена, контроля степени удерживания компонентов пробы и получения достаточной селективности разделения.
Иногда в подвижную фазу (водные буферные растворы) добавляют небольшое количество смешивающихся с водой органических растворителей - метанола, этанола, ацетонитрила, ТГФ. Сила и селективность растворителя зависят от типа и концентрации буферных ионов и других солей, от значения рН и от вида и концентрации добавленных органических растворителей.
Удерживание в ионообменной хроматографии лимитируется двумя процессами: распределением компонента пробы между водной подвижной фазой и органической неподвижной и образованием ионных пар (т.е. анионного или катионного обмена), причем последний процесс является доминирующим.
Распределение вещества между фазами зависит от силы электростатического взаимодействия заряженных ионизированных групп вещества с заряженными группами ионообменника. Некоторые гидрофобные соединения или вещества, способные образовывать водородные связи, могут неспецифическим образом взаимодействовать с материалом матрицы.
Степень удерживания образца снижается с увеличением ионной силы подвижной фазы и увеличивается с увеличением ионообменной емкости сорбента. Ионная сила подвижной фазы возрастает при возрастании концентрации буфера и сохранении неизменным рН или при добавлении соли. Важна также концентрация буферных растворов, так как в растворе наблюдается конкуренция между ионами образца и буфера. Уменьшение концентрации буферного раствора увеличивает сродство смолы к образцу, что приводит к увеличению времени удерживания. Концентрация буферного раствора колеблется от 0.001 до 6 моль/л, причем верхняя граница определяется растворимостью соли, используемой в качестве буфера, а нижняя - самой буферной силой, так как в слабом буферном растворе нельзя контролировать уровень рН. Сильных буферных растворов также следует избегать из-за вероятности выпадения осадка и закупоривания колонок. Сила растворителя зависит от типа противоиона, причем степень удерживания образца увеличивается в ряду, обратном лиотропным сериям активности ионов, приведенным выше.
При анализе рН раствора выбирают таким образом, чтобы молекула сорбата была полностью ионизирована. Изменение рН подвижной фазы влияет на удерживание ионизированного сорбата - с повышением рН времена удерживания увеличиваются при анионообменном разделении и уменьшаются при катионообменном, т.е. происходит уменьшение силы растворителя при анионном и увеличение при катионном обмене. Наиболее заметно влияние градиента рН раствора вблизи значений рКa хроматографируемого образца.
Чаще всего в ионообменной хроматографии применяют следующие буферные растворы: ацетатный, фосфатный, цитратный, формиатный, аммиачный и боратный. Селективность разделения в ионообменной хроматографии зависит от концентрации и вида буферных ионов и органических растворителей, а также от рН среды. Ионообменное разделение можно проводить при повышенных температурах (40-60°С). Чем выше температура, тем меньше вязкость подвижной фазы. С другой стороны, более высокие температуры снижают стабильность колонки. Биохимические пробы для сохранения нативных структур и биологической активности принято разделять при низких температурах (4 - 20°С).
Добавка в подвижную фазу смешивающихся с водой органических растворителей (метанол, этанол, ацетонитрил, диоксан) действует аналогично добавке этих растворителей в ОФХ: элюирующая сила растет, удерживания образца снижается. Эффект более выражен для менее полярных растворителей. Добавлением органических растворителей можно добиться также изменения селективности хроматографической системы.
Таким образом, уменьшить времена удерживания в ионообменной хроматографии позволяют следующие факторы: 1) повышение температуры; 2) повышение концентрации буферного раствора; 3) снижение степени ионизации вещества за счет изменения рН.
В хроматографии биохимических смесей используют модифицированные целлюлозы - карбоксиметилцеллюлоза (слабокислотные свойства), диэтиламиноэтилцеллюлоза (среднеосновные свойства, а также гидрофильные гели декстрана (сефадексы). На их основе выпускают иониты с карбоксиметильными, диэтиламиноэтильными, сульфоэтильными, сульфопропильными и четвертичными основными группами (CM-, DEAE-, SE-, SP- и QAE-сефадексы). Декстрановые иониты подобны макропористым ионообменным смолам. Как и целлюлозные иониты они характеризуются высокой гидрофильностью, что важно при работе с биополимерами. Они так же, как и ионобменные смолы изготавливаются в форме шариков. Однако поры декстрановых гелей больше по диаметру, в них могут проникать макромолекулы, поэтому такие иониты широко применяются главным образом в гель-хроматографии, где ионообменный механизм удерживания имеет второстепенное значение при разделении биополимеров. Аналогичное применение имеют иониты на основе производных агарозы. Например, матрица агарозы связывается с аминокислотами для получения биполярных ионитов, которые селективно реагируют с биополимерами.
Сорбенты для ионообменной хроматографии получают так же путем ковалентной прививки к силикагелю ионогенных групп. Ионообменные силикагели не набухают, не сжимаются, как смолы, и отличаются от них большим размером и доступностью внутренних пор как для ионов образца, так и для противоионов. Благодаря этому быстрее устанавливается массоперенос даже без повышения температуры и значительно возрастает эффективность сорбента. Они характеризуются высокой термической устойчивостью и выдерживают различные виды стерилизации. Однако, применение сорбентов на основе силикагеля в ионообменной хроматографии огра¬ничено рабочим диапазоном рН, в большинстве случаев верхняя граница которого не должна превышать значений равных 6-7.
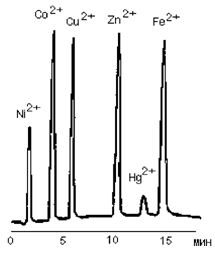
Хроматограмма ионов переходных металлов, полученная на колонке Диасорб-130-ИДК, 4x250 мм.
