Афинная хроматография
Методом афинной хроматографии разделяют полипептиды, белки и другие макромолекулы биологически активных веществ. Разделение происходит за счет различия в их биоспецифическом взаимодействии с комплементарными сорбционными центрами неподвижной фазы. По сути, это вариант лигандообменной хроматографии, дополняющий эксклюзионную и ионообменную хроматографию, применение которого необходимо, если важно сохранить активность, повысить выход и степень очистки препаративно выделяемого компонента.
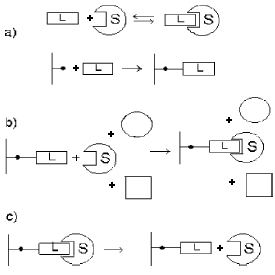
Механизм разделения веществ в афинной хроматографии: а) иммобилизация лиганда на матрице; b) нековалентное связывание целевого вещества и удаление сопутствующих примесей; с) десорбция целевого компонента.
Схематично механизм разделения в афинной хроматографии представлен на рисунке. Лиганд L фиксируется на матрице, целевой компонент разделяемой смеси S связывается лигандом и извлекается из раствора, в последующей стадии элюирования комплекс разрушается и сорбат вновь переходит в раствор. Взаимодействие вещества и лиганда должно быть обратимым. Лиганд при помощи реакционно-способных групп осуществляет связь с матрицей, сохраняя при этом биоспецифическую активность. Активные центры многих биологически активных веществ часто локализованы в середине глобулы и недоступны для небольших структур лигандов, непосредственно связанных с матрицей. Поэтому между матрицей и лигандом часто встраивают дополнительный блок - спейсер.
Для афинной хроматографии выпускают материалы с различными реакционно-способными группами. В качестве матрицы служат разнообразные гели на основе агарозы или полиакриламида. Тип геля выбирают по виду функциональных групп лиганда. Известны матрицы, на которых лиганды могут быть иммобилизированы только с помощью конденсирующих агентов. Например, в качестве конденсирующих агентов применяют водорастворимые производные карбодиимида (N-этил-N'-(3”-диметиламинопропил)-карбодиимидгидрохлорид и др.).
Лигандообменную хроматографию белков называют также металло-хелат-афинной хроматографией.
Матрица сорбента должна быть доступной для макромолекул белка, чтобы обеспечить возможность образования разнолигандных сорбционных комплексов. Этому условию удовлетворяют гели с высокой набухаемостью (сефадекс 6В, СМ-сефадекс С-50, трисакрил GF 2000 и другие так называемые аффи-гели) и слабосшитые ионообменники. В качестве подвижной фазы используют буферы в интервале значений рН от 6 (ацетатный буфер) до 8 (фосфатный буфер). Можно создать такие условия (значения рН и концентрация солей) при которых взаимодействие целевого сорбата с лигандом будет наиболее сильным. Десорбцию и элюирование связанного белка осуществляют тремя способами. Так, при понижении рН подвижной фазы происходит протонирование донорных групп белка и диссоциация его сорбционного комплекса.
Следует помнить, что иминодиацетатные группы неподвижной фазы также способны протонироваться и терять связанный с ними ион металла, в связи с этим рН меньше 5 нежелательны. Молекулы белка можно вытеснить из сорбента лигандным обменом, используя имидазол. Последний образует более устойчивый комплекс. Наконец, сорбционные комплексы можно разрушить при низких рН средним по силе хелатообразующим агентом (гистидином) или сильным хелатирующим агентом (этилендиаминтетрауксусной кислотой), что приводит к освобождению белка и десорбции металла. Этот способ эффективен для выделения ферментов, принадлежащих к классу металлопротеинов. Молекулы белка, не имеющие на своей поверхности остатков гистидина или триптофана не удерживаются гелем IDA-Cu2+, а присутствие хотя бы одного остатка гистидина в молекуле белка достаточно для его удерживания гелем IDA-Cu2+ при нейтральном значении рН. Для удерживания белков, содержащих триптофан, требуется несколько остатков этой аминокислоты в молекуле белка. Если сорбат слишком прочно связан с лигандом, в состав буфера вводят анионы ClO4-, CF3COO-, SCN-, CCl3OO-, разрушающие водородные связи.
В афинной хроматографии выделяют специальный способ, названный афинной хроматографией на лабильных лигандах. Этот вариант разработан для того, чтобы преодолеть необратимую сорбцию ряда специфических белков к кобаламину, который используется в качестве привитого к матрице хелата. Вместо ковалентной иммобилизации этого хелата гидроксикобаламин или цианокобаламин предварительно координируют с матрицей сефарозы, содержащей первичные аминогруппы. Белки, специфически связывающиеся с кобаламином, селективно сорбируются на холоде (4°С) на полученной неподвижной фазе. Затем их выделяют снова в форме комплексов с кобаламином путем повышения температуры колонки до 37°С, при которой происходит разрушение координационных связей с кобаламином. В методе афинной хроматографии на лабильных лигандах в ходе сорбции образуется одна координационная связь, а в процессе десорбции диссоциирует другая координационная связь, так что центральный ион металла вместе с дополнительным (лабильным) лигандом изменяет свою локализацию, переходя из неподвижной фазы к лабильному лиганду.
К настоящему времени разработан широкий ряд хелатообразующих сорбентов, позволяющих разделять на основе биоспецифических взаимодействий.
