Антрацен
Группа веществ:
Ароматические углеводороды
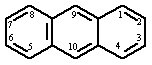
Антрацен (от греч. anthrax - уголь). Молекулярная масса 178,24; бесцветные кристаллы с голубовато-фиолетовой флуоресценцией, сохраняющейся в растворе и расплаве; t плавления 216°С, t кипения 342°С; возгоняется; d425 1,283; С° 209Дж/(г·К); ∆Н°обр -128кДж/моль, ∆Н°пл 28,86 кДж/моль, ∆S°298 207,5 Дж/(моль·К); растворимость: в этаноле - 0,076% (16°С) и 0,83% (78 °С); эфире - 1,2% (25 °С); плохо растворим в ацетоне, CS2, хлороформе, ССl4, растворим в горячих бензоле и толуоле, не растворим в воде.
Молекула антрацена - плоская, длины связей неравноценны. Антрацен - конденсированный ароматический углеводород; эмпирическая энергия резонанса 3,62 эВ, наиболее реакционноспособны положения 9 и 10 (мезо-положения), присоединение по которым не связано с большой потерей энергии резонанса. В положения 9,10 антрацен легко присоединяет диенофилы, в частности малеиновый ангидрид с образованием аддукта, который уже при слабом нагревании регенерирует исходный продукт; реакцию используют для очистки антрацена. Подобно диеновым углеводородам, антроцен присоединяет щелочные металлы, например с Na образует 9,10-динатрий-9,10-дигидроантрацен - синее легко окисляющееся вещество. При УФ-освещении растворов антрацена происходит присоединение О2 с образованием эндопероксида, разлагающегося при 120°С со взрывом. При фотодимеризации антрацена образуется труднорастворимый диантрацен, распадающийся в темноте на антрацен. Гидрируется антрацен сначала в 9,10-дигидроантрацен; на никелевом катализаторе происходит исчерпывающее гидрирование. Легко окисляется Н2СrО4, концентрированной HNO3 и др. в антрахинон. Галогенируется и нитруется с образованием продуктов 9,10-присоединения, которые легко превращаются в 9-замещенные (отщепляются молекулы галогеноводорода и элементов азотистой кислоты соответственно). 9,10-Дигалогенантрацены легко обменивают атомы галогенов на гидрокси- и сульфогруппы, образуют магнийорганические соединения и окисляются до антрахинона. 1- и 2-Галогенантрацены не синтезируются непосредственным галогенированием; их получают из соответствующих антрахинонов восстановлением Zn-пылью в NH3. Восстановление разнообразных производных антрахинона широко используется для синтеза замещенных антрацена.
Антрацен легко сульфируется; введенная в одно кольцо сульфогруппа мало влияет на реакционную способность других колец, поэтому антрацен обладает повышенной способностью к образованию дисульфокислот. При сульфировании антрацен концентрированной H2SO4 выход сульфокислот невелик из-за образования большого количества 9,9'-биантрила и полимерных продуктов. При сульфировании антроцена в диоксане действием HSO3Cl образуется 9-антраценсульфокислота, легко подвергающаяся десульфированию. В результате в реакционной среде накапливаются 1-и 2-антраценсульфокислоты. При сульфировании антрацена 100%-ной H2SO4 в уксусной кислоте образуется 1-антраценсульфокислота (выход 62%).
Антрацен содержится в антраценовом масле (каменноугольные смолы), откуда его и выделяют, очищают от примесей (главным образом от фенантрена и карбазола), промывают растворителями и перекристаллизовывают из пиридиновых оснований. Антрацен применяют для получения главным образом антрахинона, монокристаллы антрацена - для сцинтилляционных счетчиков.
Для антрацена нижний КПВ 5 г/м3, t самовоспламенения 946 °С. Пыль пожароопасна. При ее вдыхании наблюдается отек век, раздражение слизистых оболочек, жжение и зуд кожи; ПДК 0,1 мг/м3.
Хроматограммы образцов, содержащих это вещество
| Название | Колонка | Детектор |
|---|---|---|
| Стандартный раствор антрацена | Luna C18(2) 250х4.6 мм 5 мкм | Флуориметрический |
