Спирты
Спирты (алкоголи), органические соединения, содержащие в молекуле одну или несколько гидроксильных групп ОН у насыщенных атомов углерода. По количеству этих групп различают одно- (иногда термин "алкоголи" относят только к одноатомным спиртам), двух- (гликоли), трех- (глицерины) и многоатомные спирты. Спирты, содержащие две группы ОН у одного атома углерода (гем-диолы), как правило, неустойчивы. Некоторые из этих соединений, например стабилизированные внутримолекулярными водородными связями, стабильны. Спирты могут содержать Hal, группы NH2, СНО и СО, СООН, CN (соответственно галогена-спирты, аминоспирты, оксиальдегиды и оксикетоны, оксикислоты, оксинитрилы). Алифатические спирты могут быть первичными RCH2OH, вторичными RR'CHOH и третичными RR'R:СОН. Соединения с группой ОН при двойной связи относят к енолам, а при углероде ароматического кольца – к фенолам.
По номенклатуре ИЮПАК, название спирта производят прибавлением к названию соответствующего углеводорода суффикса "ол" либо префикса "гидрокси" для соединений со смешанными функциями или в случае, когда группа ОН находится в боковой цепи, например: НОСН2СН2СН(СН2ОН)СН2ОН называется 2-гидроксиметил-1,4-бутандиол. Многие спирты имеют тривиальные названия.
Свойства. Спирты – жидкости или твердые вещества, хорошо растворимы во многих органических растворителях. Низшие алифатические спирты растворимы в воде; высшие алифатические и арилалифатические спирты плохо растворимы в воде.
Алифатические спирты С1-С3 обладают характерным алкогольным запахом, С4-С5 сладковатым удушливым запахом, высшие алифатические спирты без запаха, арилалифатические спирты и терпеноиды, содержащие группу ОН, с фруктово-цветочным запахом.
Атом кислорода гидроксильной группы имеет sp3-гибридизацию. Средние длины связей 0,143 нм (С—О) и 0,091 нм (О—Н). Обе связи полярны. Полярностью группы ОН и ее способностью образовывать водородные связи объясняют относительно высокие значения температур кипения и диэлектрической проницаемости спиртов.
В ИК спектрах спиртов характеристические полосы поглощения лежат в области 3580-3670 см-1 (свободная группа ОН), 3450-3550 см-1 (внутримолекулярные ассоциаты), 3200-3400 см-1 (межмолекулярные ассоциаты). В УФ и видимой областях спектра группа ОН не поглощает. В спектрах ПМР химический сдвиг группы ОН δ 0,5-5,5 м.д., мультиплетность сигнала зависит от характера спирта: первичные спирты дают триплет, вторичные – дублет, третичные – синглет. Группа ОН обладает отрицательным индукционным и положительным мезомерным эффектами: константа Тафта σ * 1,55, константы Гамета: σмета 0,121, σпара 0,37, σ +пара 0,853.
Подобно воде, спирты проявляют амфотерные свойства. Величина рKa (вода, 25 °С) для СН3ОН 15,1, С2Н5ОН 15,9, (СН3)3СОН ≥ 19, (CF3)3COH 5,4.
Большинство реакций спиртов протекает с разрывом связей О—H или С—О. Для спиртов характерны также реакции, в которых участвуют α-H-атом (окисление), β-H-атом (дегидратация) или δ-Н-атом (окислительная циклизация).
Со щелочными, щелочноземельными и другими металлами спирты образуют алкоголяты, например:
3C2H5OH + Al HgCl2→ (C2H5O)3Al + 1,5H2
Реакция с сильными минеральными кислотами приводит либо к эфирам этих кислот (избыток кислоты), либо к простым эфирам (избыток спирта), например:
С3Н7ОН + HOSO3H ↔ C3H7OSO3H + Н2O

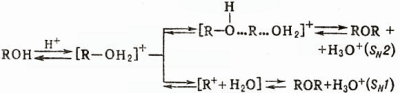
Реакция образования простых эфиров может протекать по механизмам SN2 (R и R'-первичный алкил) либо SN1 (R-mpem-алкил, аллил, бензил) в зависимости от легкости образования карбкатиона; для реакций, протекающих по механизму SN1, используют мягкие условия (разбавляют кислоты, понижают температуру) во избежание дегидратации до олефинов. Дегидратация под действием сильных минеральных кислот идет и в случае первичных или вторичных спиртов.
Простые эфиры образуются также при дегидратации спиртов в присутствии катализаторов, либо при их присоединении по кратным связям, например:
С2Н5ОН t, Al2O3-H2O→ C2H5OC2H5 + CH2=CH2
С2Н5ОН + CH3CH=CHCN OH→ CH3CH(OC2H5)CH2CN
Реакция спиртов с альдегидами в присутствии НСl, n-толуолсульфо-кислоты и других катализаторов приводит к ацеталям, например:
С2Н5ОН + СН3СНО ↔ CH3CH(OC2H5)2
При взаимодействии спиртов с карбоновыми кислотами образуются сложные эфиры: реакцию проводят в избытке спирта с одновременным удалением воды в присутствии катализаторов (HCl, BF3, H2SO4 и др.); в случае первичных и вторичных спиртов катализатор активирует кислоту, в случае третичных – спирт:
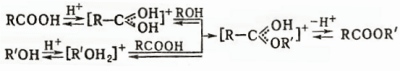
К сложным эфирам приводят также реакции спиртов с ангидридами, хлорангидридами, нитрилами, присоединение спиртов к кетенам:
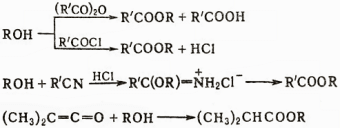
При взаимодействии спиртов с изоцианатами образуются уретаны, при взаимодействии с НСl, SOCl2, PCl3 и др. происходит обмен группы ОН на галоген (легче всего для третичных спиртов), например:
ROH + R'NCO : R'NHCOOR ROH + SOCl2 : RCl + HCl + SO2
Восстановление спиртов приводит к углеводородам, действие NH3 – к аминам (последнюю реакцию используют в промышленности для получения низших алифатических аминов), например:
RCH2OH LiAlH4, ТГФ, t→ RCH3 + H2O
C2H5OH + NH3 Al2O3-H2O→ C2H5NH2 + (C2H5)2NH + (C2H5)3N
При действии окислителей (Na2Cr2O7, KMnO4, N-бром-сукцинимид и др.) первичные спирты превращаются в альдегиды (и далее в кислоты), вторичные – в кетоны (окисление вторичных спиртов в условиях реакции Оппенауэра также приводит к ке-тонам). Такие же превращения могут осуществляться каталитическим дегидрированием спиртов в газовой (например, пропусканием паров спирта над Cu, Ag, Cr, Ni) или жидкой фазе (над Rh, Ru, Os). Третичные спирты устойчивы к окислению в нейтральных и щелочных средах, в кислой среде происходит отщепление воды и расщепление углеродного скелета с образованием кетонов или кислот с меньшим числом атомов углерода. В промышленности часто применяют каталитическое окисление спиртов кислородом воздуха (так получают СН2О из СН3ОН, СН3СНО и СН3СООН из С2Н5ОН) и электрохимическое окисление.
При окислении спиртов, содержащих δ-H-атом, происходит циклизация с образованием производных фурана, например:
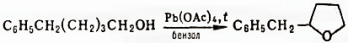
При взаимодействии С2Н5ОН с гипогалогенитами Na образуются соответственно хлороформ, бромоформ и йодоформ (т.н. галоформная реакция):
C2H5OH NaClO-NaCl→ CH3CHO NaClO-NaOH→ CCl3CHO NaOH-HCOONa→ CHCl3
Анализ. Спирты дают окрашенные соединения с соединениями Ce(IV), например аммонийцерийгексанитратом (NH4)2[Ce(NO3)6]. Для идентификации спиртов используют реакции с хлорангидридами бензойной или 3,5-динитробензойной кислоты, либо с фенил-изоцианатом, приводящие к образованию хорошо кристаллизующихся эфиров бензойной кислоты или уретанов. Для количественного определения гидроксильных групп применяют метод Церевитинова: ROH + R'MgX : ROMgX + R'H, а для смесей используют хроматографические методы.
Получение. Получают спирты гидратацией олефинов и присутствии H2SO4 или Н3РО4 (в основном алканолы С2—С4); восстановлением СО на катализаторах Zn—Сг при температуре 300-400 °С и давлении 25-45 МПа (наряду с СН, ОН образуются С3Н7ОН, изо-С4Н9ОН и алканолы С5-С14); гидролизом галогенсодержащих соединений; взаимодействием карбонильных соединений с реактивами Гриньяра, например:
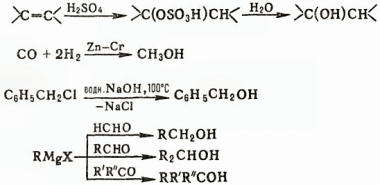
Для получения спиртов используют также восстановление карбонильных соединений натрием, его амальгамой, LiAlH4 в условиях реакции Меервейна-Понндорфа-Верлея, гидрирование в присутствии катализаторов (Pt, Ni) либо электролитическое восстановление.
Для промышленного получения бутанола, 2-этилгексанола и пента-эритрита используют альдольную конденсацию, например:
CH3CHO HCHO, Ca(OH)2→ C(CH2OH)4
Первичные спирты (в т. ч. ароматические) образуются по реакции Канниццаро либо при взаимодействии бензола с алкеноксидами в присутствии АlСl3 в условиях реакции Фриделя-Крафтса; ацетиленовые – по реакцииции Реппе; гидроксиэфиры – в условиях реакции Кнёвенагеля, например:
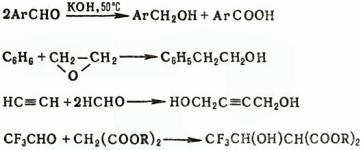
Известны другие способы синтеза спиртов: гидроборирование алкенов, гидролиз сложных эфиров, ферментативное брожение сахаров.
Применение. Применяют спирты как полупродукты в синтезе различных органических соединений (формальдегида, ацетальдегида, ацетона, уксусной кислоты, диэтилового эфира, сложных эфиров карбоновых кислот), в производстве красителей, синтетических волокон, душистых веществ, лекарственных препаратов, моющих средств, пластификаторов и мономеров, в пищевой промышленности. Спирты используют как растворители, ПАВ и др., метиловый спирт используют также в качестве моторного топлива.
Наибольшее значение имеют амиловые спирты, бензиловый спирт, бутиловые спирты, высшие жирные спирты, метиловый спирт, пентаэритрит, пропиловый спирт, β-фенил-этиловый спирт, циклогексанол, этиленгликоль, этиловый спирт.
Среди спиртов наиболее токсическим действием обладает метанол (смертельная доза 100-150 мл), окисляющийся в организме до формальдегида и муравьиной кислоты. Токсичность многоатомных спиртов невысока, за исключением этиленгликоля, образующего в организме ядовитую щавелевую кислоту.
Хроматограммы образцов, содержащих Вещества из этой группы
| Название | Колонка | Детектор |
|---|---|---|
| Углеводы, спирты, органические кислоты в браге | Rezex ROA-Organic Acid 300х7.8 мм 8 мкм | Рефрактометрический |
| Стандартная смесь углеводов, спиртов, органических кислот | Rezex ROA-Organic Acid 300х7.8 мм 8 мкм | Рефрактометрический |
| Углеводы и сорбит в соке яблочном | Rezex RCM-Monosaccharide 300х7.8 мм 8 мкм | Рефрактометрический |
| Стандартная смесь углеводов и маннитола | Rezex RPM-Monosaccharide 300х7.8 мм 8 мкм | Рефрактометрический |
