Органические кислоты

Органические кислоты (иначе, карбоновые кислоты) – органические соединения, содержащие карбоксильную группу СООН. По количеству этих групп различают одно-, двух- и многоосновные кислоты. Могут содержать Hal, а также группы NH2, С=О, ОН (соответственно галогенкарбоновые кислоты, аминокислоты, альдегидо- и кетокислоты, оксикислоты). Алифатические кислоты, у которых число атомов С в молекуле больше 6, относят к высшим жирным кислотам.
По номенклатуре ИЮПАК, кислоты называют, выбирая за основу наиболее длинную цепь, содержащую группу СООН, и добавляя к названию соединения-основы окончание "овая" и слово "кислота"; атому С карбоксильной группы приписывают номер 1, например СН3(СН2)4СН(СН3)СООН – 2-метилгептановая кислота. Часто к названию соединения-основы добавляют слова "карбоновая кислота", например С6Н11СООН – циклогексанкарбоновая кислота. При использовании этого способа наименования в алифатическом ряду атом С карбоксильной группы в нумерацию цепи не включается. Многие кислоты имеют тривиальные названия.
В свободном состоянии кислоты находятся в плодах некоторых растений, крови, выделениях животных; они входят в состав жиров, эфирных и растительных масел, восков. Важную роль карбоновые кислоты играют в обмене веществ.
Свойства. Карбоксильная группа имеет строение, промежуточное между двумя предельными структурами:

Группа планарна; длина связи С=О в различных кислотах составляет 0,118-0,126 нм, связи С–О 0,121-0,137 нм; угол ОСО 118-125,5°; μ 5,4·10-30 Кл·м. В твердом и жидком состоянии кислоты в результате возникновения водородных связей образуют устойчивые циклические димеры.
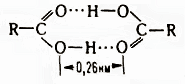
Атомы, образующие цикл, лежат практически в одной плоскости, а водородные связи (энергия 29 кДж/моль) почти линейны. В растворах кислот в инертных растворителях существует равновесие между мономером и димером. В водных растворах кислоты образуют ациклические димеры.
Насыщенные неразветвленные кислоты до С9 и разветвленные до С13 – жидкости, высшие – твердые вещества. Температуры плавления четных гомологов выше, чем ближайших нечетных. Высокие температуры кипения и плавления кислот по сравнению с соединениями с близкой молекулярной массой, но не содержащими группы СООН, обусловлены их димеризацией. Для неразветвленных насыщенных кислот, начиная с С5, ΔH0обр линейно связана с числом атомов углерода: -ΔH0обр = 458,8 + 25,5n кДж/моль, где n – число СН2-групп в молекуле кислоты. Расчетная ΔH0обр группы СООН -149,6 кДж/моль.
Важнейшее свойство кислот – их способность к диссоциации (ионизации) в водном растворе с образованием стабилизированного карбоксилатного аниона и катиона гидроксония:
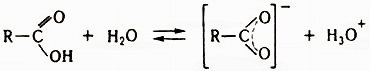
Величина рКабольшинства алифатических кислот около 4,8. Электроноакцепторные заместители, в т. ч. кратные связи, стабилизирующие карбоксилатный анион, увеличивают кислотность, электронодонорные снижают ее, однако в значительно меньшей степени. Влияние заместителя быстро падает по мере его отдаления от группы СОО-. Кислоты C1-С3 смешиваются с водой во всех соотношениях, с ростом цепи растворимость падает. ИК спектры кислот характеризуются следующими полосами поглощения ν (в см-1):
| 3550-3500 | свободная группа OH |
| 3300-2500 | связанная водородной связью группа OH |
| 1725-1700 | группа CO насыщенных алифатических кислот |
| 1715-1690 | группа CO α,β-непредельных кислот |
| 1700-1680 | группа CO ароматических кислот |
| 1680-1650 | группа CO кислот с внутримолекулярной водородной связью |
| 1610-1550 1420-1335 |
анион COO- в солях кислот |
В УФ спектре кислот имеются слабые полосы π-π*-перехода при 200-210 нм и более сильные полосы π-π*-перехода при 210-220 нм в случае α,β-ненасыщенных кислот. Спектры ЯМР характеризуются химическим сдвигом протона карбоксильной группы при δ 10,5-12 м.д.
Карбоновые кислоты образуют твердые соли RCOOM. Na- и К-соли хорошо растворимы в воде и хуже, чем исходные кислоты, в органических растворителях. Соли кислот от С11 и выше называются мылами. При действии галогенангидридов неорганических кислот (РОСl3, РСl5, РСl3, SOCl2) карбоновые кислоты образуют галогенангидриды, при дегидратации – ангидриды. Атака нуклеофильного агента на атом С карбоксильной группы лежит в основе превращения кислот во многие производные (эфиры, амиды, тиоэфиры, гидразиды и др.), а также реакций с металлоорганическими соединениями и процессов восстановления, например:
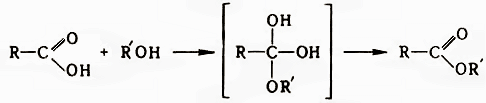
При образовании эфиров увеличение электрофильности карбонильного атома С достигается катализом ионами Н+ или предварительным превращением кислот в производные. Кислотный катализ осуществляется неорганическими кислотами, сульфокислотами, катионитами, BF3 и др. В качестве производных используют галогенангидриды и ангидриды кислот, а также реакционноспособные промежуточные соединения, получаемые in situ: О-ацилизомочевины (при действии на кислоты карбодиимидов), ацилимидазолиды (при действии N,N'-карбонилдиимидазола), N-ацилтиопиридины (при действии дипиридилсульфида и трифенилфосфина), N-ацилпиридиниевые соли (при действии N-галогенпиридиниевых солей) и др. Металлоорганические соединения реагируют с кислотами с образованием на первой стадии солей. Реакция Li-соли с литийорганическими соединениями важный метод синтеза кетонов:

Магнийорганические соединения реагируют с солями только в жестких условиях, образуя, как правило, третичные спирты. Восстановление кислот приводит к альдегидам и далее к первичным спиртам. Избирательное превращение кислот в альдегиды достигается действием Li в метиламине, где образующийся альдегид защищается растворителем в виде азометина:
RCOOH Li, CH3NH2→ RCH=NCH3 H3O+→ RCHO
Другие методы восстановления до альдегида требуют превращения кислот в их производные. Так, хлорангидриды восстанавливаются до альдегидов на Pd-катализаторах (реакция Розенмунда), хлорангидриды и ангидриды, в т.ч. смешанные, действием Na2Fe(CO)4, иминохлориды – хлористым оловом, арилсульфонилгидразиды ароматических кислот – термическим разложением в присутствии Na2CO3, разлагаются гетероциклические производные кислот, например, иодалкилаты оксазолинов, действием NaBH4. Борогидриды не восстанавливают кислоты, а LiAlH4 восстанавливают их в спирты. При одноэлектронном окислении кислот происходит их декарбоксилирование, приводящее к радикалам и далее к карбкатионам:
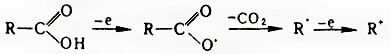
В зависимости от условий при превращении радикалов и карбкатионов образуются различные продукты: алканы, алкены, алкилгалогениды. Электроноакцепторные свойства группы СООН (константа Тафта σ * = 2,1) проявляются в избирательном α-галогенировании насыщенных кислот:
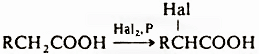
Наряду с прямым галогенированием в присутствии фосфора и его производных (реакция Гелля-Фольгарда-Зелинского), используется также взаимодействие с N-хлор- и N-бромсукцинимидами и иодирование в присутствии SOCl2. При свободнорадикальном хлорировании в сильнокислой среде кислот от С4 и выше образуются преимущественно продукты хлорирования по атому С-4. Отрицательный мезомерный эффект группы СООН (константы Гаммета σм = 0,37, σn = 0,45) дезактивирует бензольное кольцо ароматических кислот, вследствие чего не удается провести их алкилирование и ацилирование. Галогенирование ароматических кислот приводит к мета-производным. Ароматические кислоты легко восстанавливаются металлами в жидком NH3, образуя дианион, протонируемый и алкилируемый по α-положению, например:
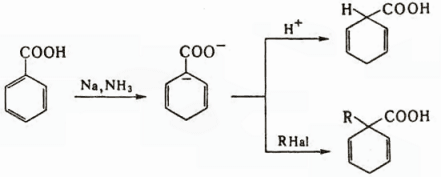
В аналогичных условиях восстанавливаются двойные связи α,β-непредельных кислот. Карбоновые кислоты с несопряженными двойными связями восстанавливаются каталитически. Особая реакция β,γ- и γ,δ-ненасыщенных кислот – галолактонизация, т.е. образование галогензамещенных лактонов:
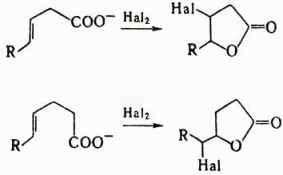
Получение. В промышленности наиболее распространены окислительные и гидролитические методы, а также гидрокарбонилирование. Окисление в присутствии солей Со, Mn, Fe, Ni, Се применяют, например, при получении кислот из альдегидов, уксусной кислоты из бутана, бензойной кислоты из толуола. Гидрокарбонилирование (гидрокарбоксилирование) проводят присоединением СО и Н2О к алкенам, алкинам, арил(алкил)галогенидам и тозилатам ароматических и алифатических спиртов под давлением в присутствии катализаторов – комплексов Ph3P с солями Pd, π-аллильных комплексов Ni либо действием карбонилов Ni или Со, например:
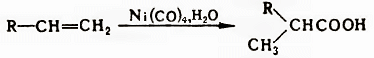
Для получения высших жирных кислот используют гидролиз животных жиров и растит масел, для получения ω-галогенкарбоновых кислот гидролиз трихлорметильной группы продуктов теломеризации олефинов и ССl4. Применяется также щелочное плавление спиртов, получаемых оксосинтезом (до С10):
RCH2OH NaOH, 250-350 °C→ RCOOH + 2H2
Уксусную и масляную кислоты получают брожением. Для препаративного синтеза кислот используют окисление первичных спиртов и альдегидов. Окислители – соединения Сr, Мn, в т.ч. солюбилизированный краун-6-эфиром КМnО4 в бензоле "пурпурный бензол", кислород в присутствии катализаторов (соли Со, Fe, Се) или без них, НIO4 и ее соли, NaClO4, система RuO2 + КIO4, а также электрохимическое окисление. Карбоновые кислоты могут быть получены также окислением арилметилкетонов, алкенов, алкинов, например:
ArCOCH3 Ti(NO3)3→ ArCH2COOH
RCH=CHR' KMnO4 - NaIO4→ RCOOH + R'COOH
RC≡CH Ti(NO3)3→ RCOOH
Их также синтезируют карбоксилированием металлоорганических соединений или действием СО2 на алкилиденфосфораны (илиды фосфора):
RR'C=PPh3 CO2→ RR'CHCOOH
Гидролиз эфиров, амидов, нитрилов и других производных кислот является как самостоятельным методом получения кислот, так и составной частью многих методов их синтеза, в том числе синтезов с эфирами малоновой и ацетоуксусной кислот, реакции Реформатского. Классический гидролиз эфиров включает разрыв О-ацильной связи под действием щелочи или кислоты. Более мягкие и избирательные методы гидролиза эфиров – О-алкильное расщепление их метиловых эфиров с помощью Li в ДМФА, этантиолята Li, NaCN в гексаметаполе, BF3 в СН2Сl2 и др. Амиды более устойчивы к гидролизу, чем эфиры, но легко гидролизуются с помощью Н2О2 в щелочной среде или нитрит-иона в кислой. Карбоновые кислоты получают также введением в органическую молекулу α-карбоксиалкильной СН2СООН или карбоксиалкилиденовой =СНСООН групп. К этим методам относятся классические синтезы на основе производных малоновой и ацетоуксусной кислот и реакции производных уксусной кислоты. Превращение диэтилового эфира малоновой кислоты в анион под действием оснований и его алкилирование галогеналкилами приводит к эфирам замещенных малоновой кислоты, деалкоксикарбонилирование и гидролиз которых дает кислоты:
CH2(COOC2H5)2 NaOC2H5, RHal→ RCH(COOC2H5)2 → RCH2COOH
Применение диизопропиламида лития и других аналогичных амидов позволило получать устойчивые дианионы монокарбоновых кислот и непосредственно вводить группу –СН2СООН:
CH3COOH LiN[CH(CH3)2]2→ CH2COO- RHal→ RCH2COOH
Другой способ введения этой группы реакции эфиров α-галогенкарбоновых кислот с карбонильными соединениями в присутствии Zn или с алкилиденфосфораном и последующий гидролиз. Используют также радикальное присоединение эфиров кислот к алкенам или аренам в присутствии пероксидов, например:
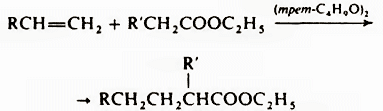
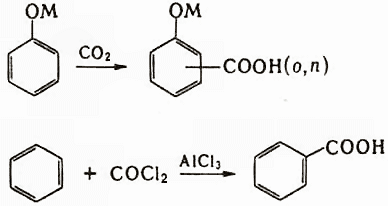
Для получения кислот из кетонов используют реакцию Байера-Виллигера, из альдегидов – реакцию Канниццаро. Кислоты синтезируются с помощью перегруппировок и реакций конденсации (реакция Дарзана, реакция Кнёвенагеля, реакция Михаэля, реакция Перкина, реакции Фаворского). Имеется несколько методов, применяемых только для синтеза ароматических карбоновых кислот, например, карбоксилирование фенолятов металлов (реакция Кольбе-Шмитта) и реакция Фриделя-Крафтса с использованием фосгена:
Разработаны специальные методы превращения кислот в высшие гомологи, например реакция Арндта-Айстерта, и перевод в низший гомолог:
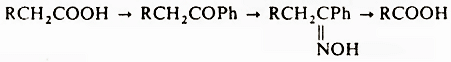
Определение. Качественный анализ основан на определении рН водных или водно-спиртовых растворов, выделении кислотами СО2 из растворов NaHCO3, образовании нерастворимых солей Рb и Ag. Цветная реакция – превращение карбоновых кислот в гидроксамовые кислоты и образование окрашенных гидроксаматов Fe. Кислоты образуют ряд производных с четкой температурой плавления, применяемых для их идентификации (анилиды, фенациловые эфиры, уреиды, соли S-бензилизотиурония, гидразиды). Методы количественного анализа включают водное и неводное титрование, определение активного водорода, например, методом Церевитинова, превращение в гидроксамовые кислоты и их колориметрическое определение, этерификацию метанолом и определение количества выделившейся воды реактивом Фишера, декарбоксилирование и определение выделившегося СО2. Широко используются тонкослойная и газожидкостная хроматографии.
Применение. Кислоты – исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов – сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот – пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей –пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы – компоненты лаков и пластмассы. Амиды кислот – эмульгаторы и флотоагенты.
Хроматограммы образцов, содержащих Вещества из этой группы
| Название | Колонка | Детектор |
|---|---|---|
| Стандартная смесь органических кислот | Rezex ROA-Organic Acid 300х7.8 мм 8 мкм | Спектрофотометрический |
| Органические кислоты в соке виноградном | Rezex ROA-Organic Acid 300х7.8 мм 8 мкм | Спектрофотометрический |
| Органические кислоты в соке ананасовом с добавкой щавелевой кислоты | Rezex ROA-Organic Acid 300х7.8 мм 8 мкм | Спектрофотометрический |
| Органические кислоты в соке ананасовом | Rezex ROA-Organic Acid 300х7.8 мм 8 мкм | Спектрофотометрический |
| Органические кислоты в соке яблочном | Rezex ROA-Organic Acid 300х7.8 мм 8 мкм | Спектрофотометрический |
| Стандартная смесь глюкозы, аскорбиновой, янтарной и фумаровой кислот | Rezex ROA-Organic Acid 300х7.8 мм 8 мкм | Спектрофотометрический |
| Препарат «Антипохмелин» | Rezex ROA-Organic Acid 300х7.8 мм 8 мкм | Спектрофотометрический |
| Органические кислоты в браге | Rezex ROA-Organic Acid 300х7.8 мм 8 мкм | Спектрофотометрический |
| Углеводы, спирты, органические кислоты в браге | Rezex ROA-Organic Acid 300х7.8 мм 8 мкм | Рефрактометрический |
| Стандартная смесь углеводов, спиртов, органических кислот | Rezex ROA-Organic Acid 300х7.8 мм 8 мкм | Рефрактометрический |
| «Кетотифен» | Synergi Max-RP 250х4.6 мм 4 мкм | Спектрофотометрический |
